Der menschliche Fuß und sein Bindegewebe
Neben Epithel-, Muskel- und Nervengewebe kennzeichnet der Sammelbegriff „Bindegewebe“ eines der vier Grundgewebe in unserem Körper. Dessen Urform ist das noch undifferenzierte embryonale Bindegewebe (Mesenchym). Es zeigt zwischen den embryonalen Bindegewebszellen reichlich Interzellularraum (auch Extrazellularraum genannt), der zunächst „nur“ mit Flüssigkeit (Grundsubstanz) gefüllt ist. In ausgereiften Binde- und Stützgeweben (unter anderem Bänder, Sehnen, Faszien, Knorpel, Knochen) hingegen haben die Bindegewebszellen diesen Raum mit solchen Strukturen (Extrazelluläre Matrix) gefüllt, die ihren Gewebebezirk auf jeweils geeignete Weise widerstandsfähig gegenüber der ortstypischen mechanischen Beanspruchung machen. Erster und immer wichtiger Bestandteil dieser extrazellulären Strukturen sind, vereinfacht ausgedrückt, Bindegewebsfasern (siehe unten).
Zugkräfte und Bindegewebsfasern
Wirken auf einen (embryonalen Bindegewebs-)Körper deformierende Kräfte ein, werden diese innerhalb des Körpers als Druck (Kompression) und, senkrecht dazu, als Zug (Dehnung) wirksam. [Auf die Darstellung einer weiteren möglichen Komponente, Schub oder Scherung genannt, wird hier verzichtet.] Für die Aufnahme und Fortleitung von Druckkräften sind vor allem die aus Bindegewebe hervorgehenden Stützgewebe Knorpel und Knochen zuständig. Zugkräfte können die Differenzierung von embryonalen Bindegewebszellen zu faserbildenden Zellen, Fibroblasten, stimulieren. Diese „Faserbildner“ produzieren Proteine, wie zum Beispiel Tropokollagen, die in den Interzellularraum ausgeschieden und dort über Zwischenstufen zu Kollagenfibrillen zusammengesetzt werden. Dies sind fadenförmige Gebilde, die akut kaum dehnbar sind (für die Vorstellung: Seile), sich von vornherein in Zugrichtung anordnen und so der Dehnung des Gewebebezirks Widerstand entgegensetzen (Kummer 2005). Kollagenfasern sind teils mächtige Bündel solcher Kollagenfibrillen, die in verschiedenen Bindegeweben aus verschiedenen biochemischen Kollagen-Typen bestehen (Typ I: Sehnen, Bänder, Faszien, Knochen; Typ II: Knorpel; Typ III entspricht den retikulären Fasern, zum Beispiel im Endomysium von Muskeln; etc.). Elastische Fasern sind im Gegensatz zu kollagenen Fasern auf mehr als das Doppelte ihrer Ausgangslänge reversibel dehnbar (für die Vorstellung: Gummibänder).Beide Haupttypen von Bindegewebsfasern kommen zumeist gemischt vor, oft überwiegen die kollagenen Fasern (zum Beispiel in Faszien), in manchen Fällen die elastischen (siehe unten).
Lockeres Bindegewebe
Diese Bindegewebsform füllt in vielen Regionen des Körpers sowohl makroskopische als auch mikroskopische Lücken und Verschiebespalten zwischen Organen und sonstigen Strukturen aus. Sie „verbindet“ auch benachbarte Schichten strafferen Bindegewebes (siehe unten) und ermöglicht deren Verschiebung gegeneinander. Lockeres Bindegewebe enthält neben den obliga-torischen ortsständigen (fixen) Bindegewebszellen (Fibroblasten) auch viele freie Zellen im Dienst der Körperabwehr (zum Beispiel Mastzellen, weiße Blutzellen sowie deren Abkömmlinge Plasmazellen und Makrophagen), die in entzündetem Gewebe vermehrt sind. Im Interzellularraum des lockeren Bindegewebes kommen kollagene und elastische Fasern vor, jedoch auch reichlich extrazelluläre (sogenannte interstitielle) Flüssigkeit, in der die freien Zellen „frei beweglich“ sind (Lüllmann-Rauch 2006).
Faserreiche Bindegewebe und Nomenklatur
In faserreichen Bindegeweben ist der oben erwähnte Interzellularraum weit überwiegend mit (kollagenen und elastischen) Bindegewebsfasern gefüllt. Die Fibroblasten, die nach Ende der aktiven Synthesephase der Fasern auch Fibrozyten genannt werden, liegen verteilt zwischen den Faserbündeln. Deren räumliche Anordnung spiegelt vor allem die Richtung der einwirkenden Zugkräfte wider und ist schon in der klassischen Anatomie mit Grundlage für die noch heute übliche Benennung verschiedener Bindegewebsformationen (Benjamin 2009; Langevin, Huijing 2009) gewesen.Der Anatomie als ältestem Grundlagenfach der (Human)Medizin oblag und obliegt die Namensgebung der biologischen Strukturen des menschlichen Körpers. Ohne ein konsistentes Begriffssystem ist missverständnisarme Kommunikation unmöglich, deshalb ist diese Aufgabe der Anatomie, nämlich als „Klammer“ zwischen den Jargons der vielen medizinischen Spezialgebiete zu wirken, kaum zu überschätzen. Die Terminologia Anatomica (TA; 1998) ist eine über 150-seitige tabellarische Auflistung anatomischer Begriffe. Sie stellt den jüngsten Kompromiss dar, historisch gewachsene Unterschiede der Benennungskulturen verschiedener nationaler und internationaler anatomischer Gesellschaften unter einen Hut zu bringen. Ziel ihrer Autoren war es, jeder Struktur im menschlichen Körper einen Namen zu geben und zu verhindern, dass mit ein und demselben Namen mehrere verschiedene Strukturen bezeichnet werden. Man kann die Unvollkommenheit der aktuellen TA bemängeln, eine andere Basis für eine einheitliche medizinische Fachsprache gibt es jedoch nicht. Der Begriff „Faszie“ (lat. fascia: Binde, Band, Gurt) ist einer der ganz wenigen, die in der TA mit einem (noch dazu langen) Kommentar versehen sind. Dieser lässt erahnen, wie schwer sich die Autoren vor allem hier mit einer Einigung getan haben. Die folgende Beschreibung versucht, den Erfordernissen der nachfolgenden Kapitel gemäß, diesen Begriff einzugrenzen.
„Mechanik pur“:Faszien und andere kollagenfaserreiche Bindegewebe
Die im Folgenden genannten Gewebe dienen vordergründig allein mechanischen Zwecken, nämlich dem Widerstand gegen Zugkräfte. Folgerichtig dominieren in ihnen kollagene Fasern, deren verschiedenartige Anordnung die jeweils unterschiedlichen Zugbelastungen widerspiegeln. Sie alle summarisch als Faszien zu bezeichnen, wäre mindestens ungenau. Im Interesse einer effektiven Kommunikation sollten, wie lange üblich, verschiedene Strukturen auch begrifflich unterschieden werden. In der TA werden als „Faszien“ Bindegewebshüllen oder -blätter aber auch andere präparierbare Bindegewebsverdichtungen bezeichnet. Basierend auf ihrer ontogenetischen Entstehung sind drei Typen zu unterscheiden. Als Kondensationsfaszien bedecken sie Muskeln oder innere Organe, deren Wachstum das ursprünglich umgebende embryonale Bindegewebe zu einer Kapsel dehnt (mechanischer Reiz für die Faserbildung!) und verdichtet. Migrationsfaszien sind Bindegewebsverdichtungen, die durch Organwanderung zurückgelassen werden. Fusionsfaszien entstehen durch die Verschmelzung seröser Häute (zum Beispiel in der Bauchhöhle).
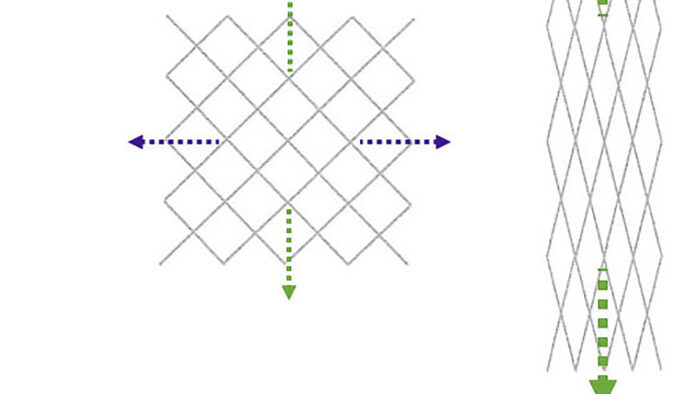
An den Extremitäten unterscheidet die TA neben individuellen Muskelfaszien Muskelgruppenfaszien (zum Beispiel Intermuskularsepten) und die oberflächliche Körperfaszie (zum Beispiel die Fascia cruris am Unterschenkel; Stecco 2009). Muskelfaszien zeigen typischerweise eine scherengitterförmige Anordnung ihrer kollagenen Fasern (Tillmann, Töndury 1987; Abb. 1). Durch Winkeländerung des Scherengitters (bei Zugeinwirkung aus verschiedenen Richtungen) erfolgt trotz prinzipieller Undehnbarkeit der kollagenen Fasern eine Verlängerung oder Verbreiterung der durch sie gebildeten Faszienfläche, die, zum Beispiel durch Mitdehnung elastischer Fasern, reversibel ist. Durch diese Eigenschaft ist die Anpassung der Faszienfläche an kontraktionsbedingte Formänderungen von Muskeln möglich. Am Muskel-Sehnen-Übergang geht auch die Muskelfaszie in eine bindegewebige Sehnenhülle über (Epitendineum).
Muskelbindegewebe
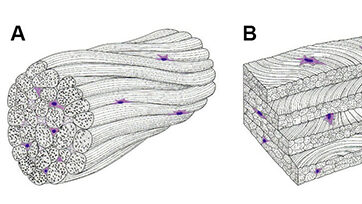
Muskelfaszien, bestehend hauptsächlich aus Kollagenfasern vom Typ I, sind nur die äußerste Schicht des Muskelbindegewebes. Durch miteinander verbundene Komponenten, die jeweils verschiedene Aufgaben erfüllen und sich auch in der Zusammensetzung aus verschiedenen Kollagenfasertypen unterscheiden, erhält jeder Muskel eine Binnengliederung (Drenckhahn 2003). Das Epimysium ist eine lockere, bindegewebige Verschiebeschicht zwischen Muskelfaszie und Muskelaußenfläche, das Perimysium untergliedert den Muskel in Sekundär- und Primärbündel (erstere bedingen die typische Fleischmaserung), es führt die sich verzweigenden Gefäße und Nerven und stellt zusammen mit dem Endomysium an den Muskelenden die Verbindung zu den Sehnen her. Das Endomysium (vor allem bestehend aus Kollagenfasern vom Typ III und V) bedingt die Reißfestigkeit der einzelnen Muskelfasern, mit deren Basalmembran (Kollagenfasern Typ IV und VI) es verbunden ist (Lüllmann-Rauch 2006).
Sehnen und Bänder
Sehnen (Einz.: Tendo; zwischen Muskel und Knochen) und Bänder (Einz.: Ligamentum; meist zwischen Knochen) weisen in Zugrichtung weitgehend parallel verlaufende kollagene Faserbündel auf, deren Aufgabe Zugkraftübertragung beziehungsweise die Führung und Begrenzung von Gelenkbewegungen ist (Abb. 2). „Achilles-Faszie“ statt der klassischen „Achilles-Sehne“ wäre des „Unkonventionellen“ und „Modernen“ denn doch zu viel!
Aponeurosen
Aponeurosen sind die flachen Sehnen oft ebenso flacher Muskeln. Obwohl diese Definition sie scheinbar klar von Faszien unterscheidet, ist eine klare Trennung dieser beiden Bindegewebsblätter mancherorts schwierig. Faszien (zum Beispiel am proximalen Unterschenkel) können Muskeln als Ursprungsfläche dienen. Dadurch entwickeln sie einen aponeurotischen (= sehnigen) Charakter: ihre Kollagenfasern sind aufgrund der eindimensionalen Zug-Beanspruchung parallel und nicht scherengitterartig angeordnet.
Haltebänder
Haltebänder (Einz.: Retinaculum) sind, zum Beispiel am Übergang vom Unterschenkel zum Fuß, Verstärkungszüge der oberflächlichen Körperfaszie, die zur Fixierung langer Sehnen vorwiegend auf Zug beansprucht sind und deshalb auch eine mehr parallele Fasertextur aufweisen als die umliegenden Faszienbereiche. Hier erhält also ein Faszienabschnitt, der aufgrund spezialisierter Belastung eine entsprechend spezialisierte Struktur aufweist, einen gesonderten Namen, um den genannten Unterschieden Rechnung zu tragen!
Lederhaut
Die Lederhaut (Dermis, Corium; Abb. 2) besteht aus einem dreidimensionalen kollagenen Faserfilz mit eingelagerten elastischen Fasern. Die vielen verschiedenen Winkel der Faserbündel spiegeln die potenzielle Vielfalt der einwirkenden Zugrichtungen auf die Haut insgesamt wider.
„Mechanik plus“: Kollagenfaserreiche Bindegewebe mit zusätzlichen Funktionen
Die im Folgenden genannten Gewebe dienen nicht allein mechanischen Zwecken, sie besitzen außer kollagenen Fasern Zellschichten mit anderen, spezialisierten Funktionen. Diese Strukturen mit Faszien „in einen Topf“ zu werfen, wäre nicht nur ungenau, sondern falsch. Einige prominente Beispiele seien genannt:
Gelenkkapseln, Sehnenscheiden, Schleimbeutel
Gelenkkapseln, Sehnenscheiden und Schleimbeutel besitzen neben ihrer äußeren, faserreichen (faszienähnlichen) eine innere Schicht, deren Zellen die Synovia (eine viskose Flüssigkeit) des jeweiligen Spaltraums produzieren. Alle drei Spezialisierungen sorgen vor allem für Reibungsminderung.
Knochenhaut, Knorpelhaut
Die Knochenhaut (Periost) ist einerseits ebenfalls eine faserreiche Bindegewebshülle, deren innere Schicht jedoch
Zellen beherbergt, die am umhüllten Knochen jederzeit Umbau- und Reparationsvorgänge initiieren können. Ähnlich verhält es sich mit der Knorpelhaut (Perichondrium), deren innere Zellen appositionelles Knorpelwachstum bewirken können.
Hirn- und Rückenmarkshäute
Hirn- und Rückenmarkshäute umhüllen nicht nur als Bindegewebsschichten das Zentrale Nervensystem, sondern sorgen mit einer speziellen Zellschicht („Neurothel“ an der Grenze zwischen Arachnoidea und Dura mater) für die Begrenzung des Flüssigkeitsraums (Liquor cerebrospinalis), von dem Gehirn und Rückenmark umgeben sind. Diese Grenze ist vor allem immunologisch bedeutsam, indem sie maßgeblich ein eigenes Milieu für das zentrale Nervengewebe aufrechterhält.
Faserreiche elastische Bindegewebe
Dies sind zum Beispiel die Ligamenta flava („gelbe“ Bänder; am frischen Präparat gelblich schimmernd wegen ihres hohen Gehalts an elastischen Fasern). Diese Wirbelsäulenbänder sind zwischen den Wirbelbögen ausgespannt und werden bei Vorbeugung gedehnt. Mit Wiederaufrichtung der Wirbelsäule spart ihre elastische Rückstellkraft Energie, die nämlich von den streckenden Muskeln entsprechend weniger aufgewendet werden muss. Das Nackenband, Ligamentum nuchae, ist beim Zweibeiner Mensch im Gegensatz zu vielen Vierbeinern weniger kräftig, besteht aber ebenfalls vornehmlich aus elastischen Fasern.
Unser Fuß: Evolution vom Greiffuß zum Stützfuß
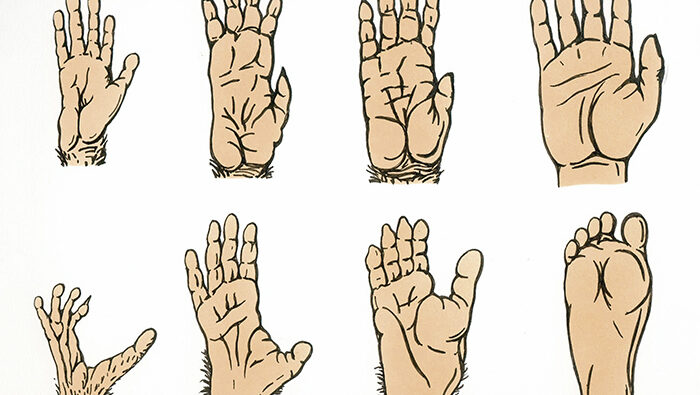
Vor etwa 7 Mio Jahren trennten sich vor allem im ostafrikanischen Hochland die Entwicklungslinien zu Schimpanse und Mensch (Henke, Rothe 2003, Schrenk 2008). Die Vorfahren der heutigen Schimpansen lebten seitdem unverändert in geschlossenen Wäldern, Schimpansen richten sich auch heute allenfalls kurzfristig auf zwei Beine auf. Dagegen wurde außerhalb geschlossener Wälder der aufrechte, zweibeinige Gang für die noch affenartigen Vormenschen zur gattungsspezifischen Fortbewegungsart. Die dafür notwendigen Anpassungen des Skeletts erfolgten gewissermaßen „von unten nach oben“, indem sich zunächst vor allem Bein, Beckengürtel und Wirbelsäule adaptierten. Erst später, mit dem endgültigen Verlassen der Bäume als Lebensraum, veränderte sich auch die obere Körperhälfte markanter. Vergleicht man die Vorder- und Hinterfüße rezenter Menschenaffen miteinander (Abb. 3: Orang Utan, Schimpanse), so fällt deren prinzipielle Ähnlichkeit auf oder anders ausgedrückt: Ein Laie würde sich mit der zweifelsfreien Unterscheidung von Vorder- und Hinterfuß schwertun. Dies ist beim Menschen kein Problem, auf den ersten Blick und somit sprachlich sind Hand und Fuß unverwechselbar. Dieser gewachsene Unterschied liegt jedoch weniger im Aufbau unserer Hand begründet, die zwar unzweifelhaft eine enorme Bedeutung für die menschliche Evolution hatte. Jedoch ähnelt ihre Struktur eher der der Vorder- und Hinterfüße unserer tierischen Verwandten als die Struktur unseres Fußes der irgendwelcher Menschenaffenfüße. Die mit dem Erwerb des dauerhaften aufrechten Gangs erfolgte Umbildung vom Greiffuß zum reinen Stützfuß macht den menschlichen Fuß einzigartig (Storch et al. 2007, Hardt et al. 2009).Neben veränderten Proportionen am Fußskelett (unter anderem verkürzte Zehen und verlängerte Fußwurzel) sind es vor allem zwei qualitative Merkmale, die den menschlichen Fuß vom Schimpansenhinterfuß unterscheiden: der Großzehenstrahl ist an den restlichen Mittelfuß fixiert (‚adduziert‘) und es sind deutliche Wölbungen des Fußwurzel- und Mittelfußskeletts vorhanden (Campbell 1972).
Veränderungen während der Ontogenese des menschlichen Fußes
Der obligatorische zweibeinige Gang des (Vor-)Menschen hat sich phylogenetisch erst spät (vor „nur“ wenigen Millionen Jahren) etabliert. Es verwundert daher nicht, dass die endgültige Ausprägung der oben beschriebenen Fußskelettmerkmale auch ontogenetisch spät, zum Teil postnatal und gekoppelt an den individuellen Erwerb des zweibeinigen Gangs, erfolgt.Fetale menschliche Füße zeigen zum Beispiel noch deutlich gespreiztere Zehen als die Erwachsener. Unter den Köpfen der Zehengrundgelenke findet man jetzt auch noch Andeutungen sogenannter Tastballen, die anderen Primaten (zum Beispiel Rhesus-Affen) zeitlebens wesentlich differenziertere Tastfunktionen auch ihrer Hinterfüße erlauben. Sowohl Quer- als auch Längswölbung, letztere im Zusammenhang mit der Positionsänderung zwischen Talus und Calcaneus, werden erst mit dem Laufenlernen im Kleinkindalter deutlich und prägen sich dann bis zum Wachstumsende im frühen Erwachsenenalter endgültig aus (Lang, Wachsmuth 1972).
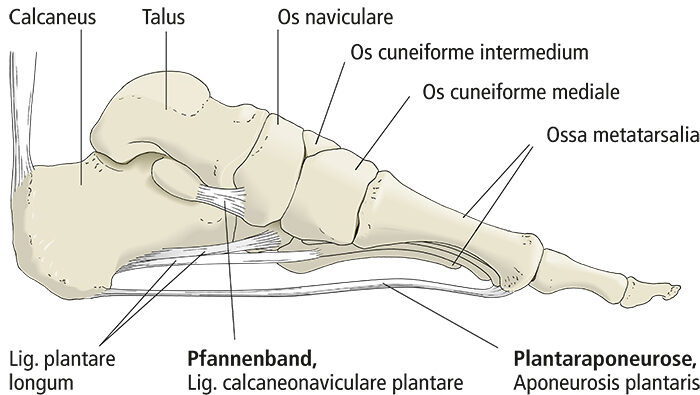
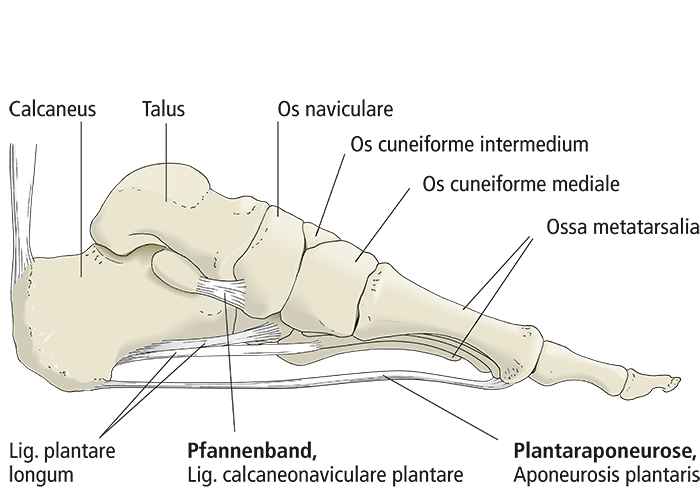
Adduzierter Großzehenstrahl und Bindegewebe
Beim Greiffuß des Schimpansen und anderer Menschenaffen ist der Großzehenstrahl abgespreizt, das heißt ähnlich unserem Daumen ist nicht nur die Großzehe selbst, sondern auch der zugehörige Mittelfußknochen (Os metatarsale I) erheblich gegenüber dem restlichen Mittelfuß abgesetzt und beweglich. Die Abduktions- und Pronationsfähigkeit des gesamten Großzehenstrahls gegenüber dem restlichen Mittelfuß ist die Grundlage für die Greiffähigkeit des Hinterfußes, worin dieser dem Vorderfuß und der menschlichen Hand ähnelt. Anders der menschliche Fuß: Der Mittelfußknochen I verläuft nahezu parallel zu den übrigen Mittelfußknochen. Nach proximal ist dieses Os metatarsale I mit dem Os cuneiforme mediale über eine Amphiarthrose, ein kaum bewegliches Gelenk, verbunden. Distal sichern mehrere quere Bänder den Zusammenhalt zwischen den Köpfen der ersten beiden
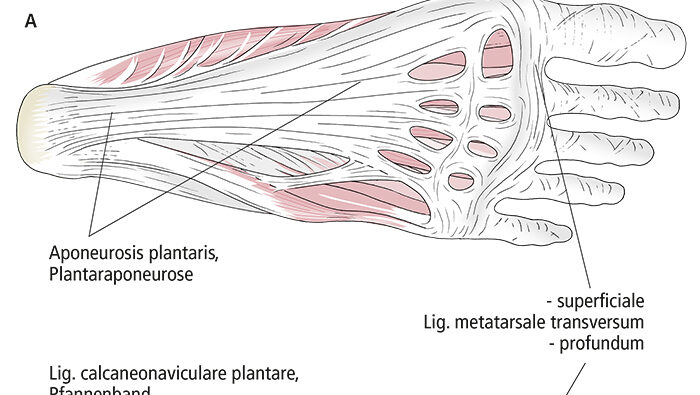
Metatarsalknochen (Abb. 4). Das Ligamentum metatarsale transversum superficiale kann als Querverbindung der distalen Längsausläufer der Plantaraponeurose aufgefasst werden und stellt unter anderem die Verbindung zur Subkutis her. Das Ligamentum metatarsale transversum profundum „zurrt“ in der Tiefe die Köpfe der Mittelfußknochen I und II aneinander. Dieses Band befestigt sich in den Bindegewebspolstern der plantaren Kapselanteile aller fünf Zehengrundgelenke. An unserer Hand und an allen Vorder- und Hinterfüßen der Menschenaffen fehlt diese bindegewebige Fixierung zwischen den Köpfen der Mittelhand- beziehungsweise Mittelfußknochen I und II.
Längswölbung und Bindegewebe
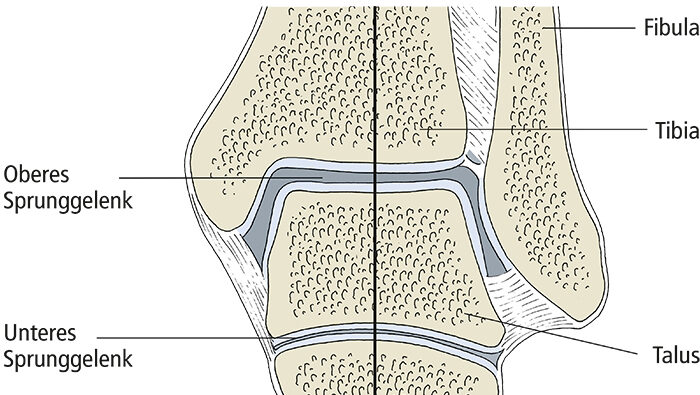
In Längsrichtung ist unser Fuß zwischen der Ferse (dem Tuber calcanei) und den Köpfen der Mittelfußknochen gewölbt. Entscheidend dafür ist die Lage des Talus über dem Calcaneus. Von einer Position jeweils schräg über dem Calcaneus ausgehendend „wandert“ der Talus sowohl phylogenetisch als auch ontogenetisch so auf den Calcaneus, dass nach Etablierung der Zweibeinigkeit die nun horizontalen Gelenkspalten von Oberem Sprunggelenk und Unterem Sprunggelenk beim Stehen senkrecht von der (Körper-)Last getroffen werden (Abb. 5). Die Längswölbung ist am medialen Fußrand höher als am lateralen (manifestiert durch den gesunden menschlichen Fußabdruck), am höchsten ist der Bogen des 2. Längsstrahls mit dem Os cuneiforme intermedium und dem Os metatarsale II.Wie die Querwölbung ist die Längswölbung kein echtes, selbsttragendes Gewölbe. Die Formen der Fußwurzel- und Mittelfußknochen sind für die Aufrechterhaltung der Wölbungen des Fußskeletts nur ein nachgeordneter Faktor. Die Knochen müssen plantar „verklammert“ werden, damit die Wölbungen den verschiedenen abflachenden Einflüssen „widerstehen“ können. Hierfür kommen hauptsächlich plantare, im Fall der Längswölbung längsverlaufende Strukturen infrage: Muskeln und spezialisiertes Bindegewebe, nämlich Bänder sowie Sehnen langer Unterschenkelmuskeln. Von besonderer Bedeutung und deshalb hier hervorzuheben sind drei Bandstrukturen (Drenckhahn 2003; Abb. 4, 6): Die Plantaraponeurose, das Ligamentum plantare longum und das Pfannenband.
Plantaraponeurose
Die Plantaraponeurose (Aponeurosis plantaris) verspannt als einzige die gesamte Strecke der Längswölbung. Obwohl sie als so genannte Aponeurose scheinbar nicht die flache Sehne eines Muskels zu sein scheint, so ist sie phylogenetisch doch aus einer solchen, nämlich der der Wadenmuskulatur, hervorgegangen (dies ist der entwicklungsgeschichtliche Grund für ihre Bezeichnung als Aponeurose; zum strukturellen Grund s. u.): Die Ferse (Tuber calcanei) entsteht durch die phylogenetisch erfolgte Fusion eines ursprünglichen Sesambeins mit dem Calcaneus, so wurde die Verbindung zwischen der Wadenmuskulatur und ihrer plantaren Aponeurose durch die neu erworbene Ferse unterbrochen (Starck 1979; Kummer 2005). [An der Hand ist die Verbindung des M. palmaris longus mit der Palmaraponeurose noch häufig.]
Ligamentum plantare longum
Das Ligamentum plantare longum liegt lateral und zieht vom Calcaneus zum Os cuboideum und den Basen der Mittelfußknochen V-II.
Pfannenband
Das Pfannenband (Ligamentum calcaneonaviculare plantare) liegt im Scheitel der Längswölbung am medialen Fußrand und hat seinen Namen von einer weiteren Funktion: der Beteiligung an der Bildung einer Gelenkpfanne, nämlich der der vorderen Abteilung des Unteren Sprungelenks. Beim Plattfuß ist dieses Band überdehnt.
Querwölbung und Bindegewebe
Eine Querwölbung existiert im distalen Fußwurzel- und proximalen Mittelfußbereich. Da der mediale Rand des gesunden Fußes beim Stand keinen Bodenkontakt hat, ist hier besonders auffällig, dass die Knochen allein die Querwölbung nicht aufrechterhalten könnten. Für die Stabilisierung dieser Wölbung wichtig sind vor allem schräg an der Fußsohle verlaufende Sehnen von Unterschenkelmuskeln, deren Zugkräfte jeweils in (die Längswölbung stützende) Längs- sowie Querkomponenten (Abb. 7) zu unterteilen sind. Die Sehne des Musculus fibularis (= peroneus) longus zieht plantar, nach ihrer Umleitung am lateralen Fußrand, diagonal von hinten/lateral nach vorn/medial. Sie wird dabei, umgeben von einer Sehnenscheide, in einem osteofibrösen Kanal vom Ligamentum plantare longum fixiert. Ihr Ansatz erfolgt am Os cuneiforme mediale und der Basis des Os metatarsale I, also den beiden Knochen, an denen von medial kommend auch der Musculus tibialis anterior inseriert.Die Sehne des Musculus tibialis posterior verläuft nach Erreichen der Fußsohle von hinten/medial nach vorn/lateral. Sie spaltet sich stärker auf und setzt an mehreren Fußwurzel- sowie Basen vom Mittelfußknochen an. Neben ihrem schrägen Verlauf trägt auch dieser fächerförmige Ansatz an mehreren, die Querwölbung bildenden Knochen (unter anderem der Keilbeine: Ossa cuneiformia) dazu bei, sie plantar aneinander zu klammern und ihr Auseinanderweichen zu verhindern.
Funktionen des Stützfußes
Die oben beschriebenen qualitativen Merkmale (Adduzierter Großzehenstrahl, Wölbungen) bewirken, dass die Unterschenkelmuskeln ihre Kontraktionskraft über das Obere Sprunggelenk auf den Fuß als in sich kaum beweglichen und damit einheitlichen Hebel übertragen können. Dieser Effekt wird komplettiert durch Proportionsänderungen an Fußwurzel und Mittelfuß sowie erhebliche Verkürzung der Zehen (Campbell 1972). Eine Greiffunktion ist an diesem Stützfuß so kaum noch vorhanden. Seine Komponenten bringen jedoch andere Vorteile mit sich.
Widerlager für Sehnenansätze
Vor allem der Sehnenfächer des Musculus tibialis posterior versteift durch seinen Zug an mehreren Knochen (unter anderem den Keilbeinen) die Querwölbung, was dem Muskel gleichzeitig den nötigen stabilen Ansatz verschafft.
Druckverteilung und Standsicherheit
Vom Talus aus wird die Last über die beiden Schenkel der Längswölbung nach vorn und hinten verteilt.
Elastizität und Energiespeicherung
Während der verschiedenen Standbeinphasen beim Gehen kommt es auf Grund einwirkender Druck- (zwischen Fußsohle und Auflagefläche) sowie Zugkräfte (des Musculus triceps surae an der Ferse – der Streckmuskeln am Vorfuß) tendenziell zu einer Abflachung der Längswölbung. Da die kollagenen Fasern der beschriebenen plantaren Bänder bei Entspannung geringfügig spiralig verlaufen, werden sie durch Zug, bei Abflachung der Wölbung, in den gestreckten Verlauf gezwungen. Zum einen resultiert daraus eine Elastizität des Fußes, die wie überall im Bewegungsapparat eine nicht abrupte, sondern allmähliche, gleitende Kraftübertragung ermöglicht. Zum anderen bedingt die Spannung der eingewobenen elastischen Fasern auch Speicherung von Energie. Die Rückstellkräfte der gespannten elastischen Elemente bewirken in der letzten Standbeinphase, beim Abstoßen des Vorfußes, die Rückkrümmung zum „Ruhe-Zustand“. Die dabei frei werdende Energie geht mit dem Abstoßen des Fußes in die Vorwärtsbewegung über.
Hebelwirkung
Die Ausrichtung der Längsachse des Calcaneus (entspricht etwa dem hinteren Teil der Längswölbung) bedingt geänderte Hebelverhältnisse im Oberen Sprunggelenk. So ist bei der für unsere Fortbewegung so wichtigen Plantarflektion eine noch effektivere Kontraktionskraftübertragung des Musculus triceps surae über die Achilles-Sehne auf das Fußskelett möglich.
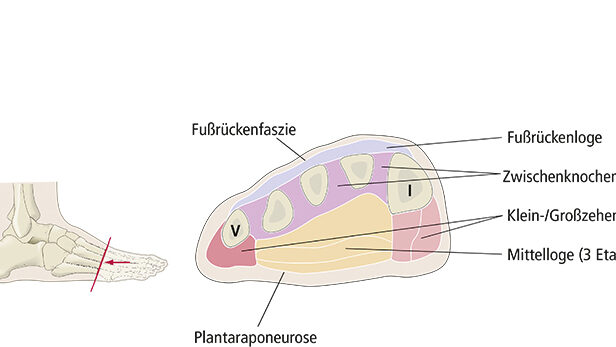
Überblick über die Bindegewebsblätter des Fußes (Abb. 8)
Fußrückenfaszie
Die Fußrückenfaszie, Fascia dorsalis pedis, ist die oberflächliche Körperfaszie des Fußrückens. Da viele Sehnen von Unterschenkelmuskeln bei ihrem Verlauf zum Fuß mindestens einmal umgelenkt werden, ist die Faszie am Übergang zum Fuß zu Haltebändern (Retinacula) verstärkt: auf der Vorderseite für die drei Extensorensehnen, hinter und unter dem medialen Knöchel für die tiefen Beugersehnen sowie hinter und unter dem lateralen Knöchel für die zwei Fibularis-/Peroneussehnen. Alle diese Sehnen besitzen unter den Retinacula Sehnenscheiden zur Minimierung der Reibung. Eine weitere dorsale, jedoch tiefer gelegene Faszie (gelegentlich als tiefes Blatt der Fußrückenfaszie bezeichnet; Tillmann, Töndury 1987) bedeckt Knochen (genauer: die Knochenhaut – Periost), Bänder und die Faszien der Zwischenknochenmuskeln (Mm. interossei).
Plantaraponeurose
Die Plantaraponeurose, Aponeurosis plantaris, findet man an der Fußsohle statt einer typischen Faszie. Sie dient vor allem der Verspannung der Längswölbung und dem Ursprung kurzer, längsverlaufender Fußmuskeln. Ihre Kollagenfasern weisen wegen der einseitigen, längsgerichteten Zugbeanspruchung auch keine typische Scherengitteranordnung auf. Es dominieren stattdessen längsverlaufende Faserzüge (diese sind der strukturelle Grund für ihre Bezeichnung als Aponeurose), daneben existieren auch Querverbindungen dort, wo die Längsfasern sich in Richtung der Zehen aufspalten. Als deren am weitesten distal gelegene lässt sich das Ligamentum metatarsale transversum superficiale interpretieren. Auch wenn neuerdings die „Plantaraponeurose“ häufig als „Plantarfaszie“ bezeichnet wird, so ist dies also weder aus strukturellen (dieser Absatz), noch aus entwicklungsgeschichtlichen Gründen (siehe „Längswölbung und Bindegewebe“) gerechtfertigt.
Muskelfaszien
Muskelfaszien finden sich an allen kurzen Fußmuskeln.
Intermuskularsepten
Intermuskularsepten (für die Vorstellung: flexible Bindegewebswände) trennen die Mittelloge der kurzen Fußmuskeln von der Groß- beziehungsweise der Kleinzehenloge.
Subkutanes Bindegewebe
Das subkutane Bindegewebe zwischen Plantaraponeurose und Sohlenhaut ist durch eine dicke Fettschicht und dessen Kammerung durch straffes Bindegewebe gekennzeichnet. Diese Bindegewebsarchitektur dient der Druckverteilung und unterstützt so die oben genannten Funktionen des Fußskeletts.
Gefäß-Nervenscheiden
Gefäß-Nervenscheiden, zum Beispiel in Intermuskularsepten gelegen, haben gerade an der unteren Extremität einen erheblichen Einfluss auf den venösen Blutrückfluss (arterio-venöse Kopplung).
Fazit: Was sind Faszien und was nicht?
Bildung und Aufrechterhaltung der menschentypischen Fußarchitektur sind maßgeblich an verschiedene Bindegewebskomponenten gekoppelt. Hierzu gehören vor allem Sehnen von Unterschenkel- und Fußmuskeln, Bänder zwischen Knochen des Fußskeletts, die Plantaraponeurose mit längs und quer orientierten Faseranteilen sowie Faszien, die Fußmuskeln, -muskelgruppen und als oberflächliche Körperfaszie den Fußrücken überziehen. Sie sind so an der Aufrechterhaltung der räumlichen Ordnung der Fußweichteile beteiligt. Über die enge strukturelle Definition des Begriffs „Faszie“ (Scherengitteranordnung kollagener Fasern) hinaus können alle Bindegewebsblätter und -hüllen als Faszie bezeichnet werden, die neben den allgemeinen Merkmalen faserreicher Bindegewebe keine zusätzlichen, spezialisierteren Strukturen aufweisen und entsprechende gesonderte Funktionen erfüllen. Es wird unserem hochdifferenzierten Bindegewebssystem ganz sicher nicht gerecht, mehr oder weniger alle Bindegewebsformen unter dem Oberbegriff „Faszien“ zu subsumieren. Eine Sammelbezeichnung, nämlich „Binde- und Stützgewebe“, existiert seit mehr als hundert Jahren, sie bezieht neben hier nicht erwähnten Bindegewebsformen auch Knorpel- und Knochengewebe mit ein, die nichts anderes sind als hoch differenzierte und spezialisierte Bindegewebe. «
Ausgabe 01/02 2016
- M. Benjamin: The fascia of the limbs and back – a review. J Anat 214 (2009) 1 – 18.
- B.G. Campbell: Entwicklung zum Menschen. Fischer-Verlag, Stuttgart, 1972.
- D. Drenckhahn: Benninghoff Drenckhahn Anatomie, Band 1. Urban & Fischer, München, 2003.
- T. Hardt, B. Herkner, U. Menz: Safari zum Urmenschen. Schweizerbart’sche Verlagsbuchhandlung, Stuttgart, 2009.
- W. Henke, H. Rothe: Menschwerdung. Fischer Taschenbuch Verlag, Frankfurt/M., 2003.
- P.A. Huijing: Epimuscular myofascial force transmission: A historical review and implications for new research. International society of biomechanics Muybridge award lecture, Taipei, 2007. J Biomechanics 42 (2009) 9 – 21.
- W. Kummer: Biomechanik. Deutscher Ärzte-Verlag, Köln, 2005.
- J. Lang, W. Wachsmuth: Lanz/Wachsmuth Praktische Anatomie: Bein und Statik. Springer-Verlag, Berlin, 1972.
- H.M. Langevin, P.A. Huijing: Communicating about fascia: history, pitfalls, and recommendations. Int J Therap Mass Bodywork 2/4 (2009) 3 – 8.
- R. Lüllmann-Rauch: Histologie. Thieme-Verlag, Stuttgart, 2006.
- F. Paulsen, J. Waschke: Sobotta Atlas der Anatomie des Menschen, Bd 1. Urban & Fischer, München, 2010.
- C. Roggenbuck: Gefühltes Netzwerk. Orthopädieschuhtechnik 02 (2014) 20 – 25.
- F. Schrenk: Die Frühzeit des Menschen. Verlag C.H. Beck, München, 2008.
- D. Starck: Vergleichende Anatomie der Wirbeltiere, Bd. 2: Das Skelettsystem. Springer-Verlag, Berlin, 1979.
- C. Stecco, P.G. Pavan, A. Porcionato, V. Macchi, L. Lancerotto, E.L. Carniel, A.N. Natali, R. De Caro: Mechanics of crural fascia: from anatomy to constitutive modelling. Surg Radiol Anat 31 (2009) 523-529.
- V. Storch, U. Welsch, M. Wink: Evolutionsbiologie. Springer-Verlag, Berlin, 2007.Terminologia Anatomica. Thieme-Verlag, Stuttgart, 1998.
- B. Tillmann, G. Töndury: Rauber/Kopsch Anatomie des Menschen, Band I: Bewegungsapparat. Thieme-Verlag, Stuttgart, 1987.
- M. Benjamin: The fascia of the limbs and back – a review. J Anat 214 (2009) 1 – 18.
- B.G. Campbell: Entwicklung zum Menschen. Fischer-Verlag, Stuttgart, 1972.
- D. Drenckhahn: Benninghoff Drenckhahn Anatomie, Band 1. Urban & Fischer, München, 2003.
- T. Hardt, B. Herkner, U. Menz: Safari zum Urmenschen. Schweizerbart’sche Verlagsbuchhandlung, Stuttgart, 2009.
- W. Henke, H. Rothe: Menschwerdung. Fischer Taschenbuch Verlag, Frankfurt/M., 2003.
- P.A. Huijing: Epimuscular myofascial force transmission: A historical review and implications for new research. International society of biomechanics Muybridge award lecture, Taipei, 2007. J Biomechanics 42 (2009) 9 – 21.
- W. Kummer: Biomechanik. Deutscher Ärzte-Verlag, Köln, 2005.
- J. Lang, W. Wachsmuth: Lanz/Wachsmuth Praktische Anatomie: Bein und Statik. Springer-Verlag, Berlin, 1972.
- H.M. Langevin, P.A. Huijing: Communicating about fascia: history, pitfalls, and recommendations. Int J Therap Mass Bodywork 2/4 (2009) 3 – 8.
- R. Lüllmann-Rauch: Histologie. Thieme-Verlag, Stuttgart, 2006.
- F. Paulsen, J. Waschke: Sobotta Atlas der Anatomie des Menschen, Bd 1. Urban & Fischer, München, 2010.
- C. Roggenbuck: Gefühltes Netzwerk. Orthopädieschuhtechnik 02 (2014) 20 – 25.
- F. Schrenk: Die Frühzeit des Menschen. Verlag C.H. Beck, München, 2008.
- D. Starck: Vergleichende Anatomie der Wirbeltiere, Bd. 2: Das Skelettsystem. Springer-Verlag, Berlin, 1979.
- C. Stecco, P.G. Pavan, A. Porcionato, V. Macchi, L. Lancerotto, E.L. Carniel, A.N. Natali, R. De Caro: Mechanics of crural fascia: from anatomy to constitutive modelling. Surg Radiol Anat 31 (2009) 523-529.
- V. Storch, U. Welsch, M. Wink: Evolutionsbiologie. Springer-Verlag, Berlin, 2007.Terminologia Anatomica. Thieme-Verlag, Stuttgart, 1998.
- B. Tillmann, G. Töndury: Rauber/Kopsch Anatomie des Menschen, Band I: Bewegungsapparat. Thieme-Verlag, Stuttgart, 1987.